-
Izdelki
-
Laboratorijski instrumenti
- Merilniki in sonde
- Kemične snovi, reagenti in standardi
-
Online Analysers
Skupni organski ogljik TOC EZ Series Analysers
- Iron
- Aluminium
- Manganese
- Phosphate
- Chloride
- Cyanide
- Fluoride
- Sulphate
- Sulphide
- Arsenic
- Chromium
- Copper
- Nickel
- Zinc
- Ammonium
- Total Nitrogen
- Total Phosphorus
- Phenol
- Volatile Fatty Acids
- Alkalinity
- ATP
- Hardness
- Toxicity
- Sample Preconditioning
- Boron
- Colour
- Nitrate
- Nitrite
- Silica
- Hydrogen Peroxide
- EZ Series Reagents
- EZ Series Accessories
- EZ sc Series Inorganics
- EZ sc Series Metals
- EZ sc Series Nutrients
- Samodejni laboratorijski sistemi
-
On-line senzorji in kontrolne enote
Senzorji pH in ORP
- 1200-S Redox
- 1200-S pH
- 12mm pH/Redox
- Diferencialna pH
- Digitalna diferencialna Redox
- Digitalna diferencialna pH
Obdelava vzorcev Senzorji prevodnosti - Vzorčenje
-
Mikrobiologija
Dehidrirani mediji Dodatna oprema in kemikalijeLaboratorijska oprema
- Dodatna oprema
- Liji, črpalke in razdelilci
- Mikrobiologija - filtri
- Pertijevke in dodatna oprema
- Viale, cevi, steklenice, stojala
- Vrečke za vrorce
-
Laboratorijska oprema
NapravaSteklene/plastične posodeSplošni laboratorijski potrošni material
- Kompleti testov in testni trakovi
- Programska oprema in varnost
- Claros Water Intelligence System
- Electrochemistry
-
Laboratorijski instrumenti
- Parametri
-
Programske rešitve
-
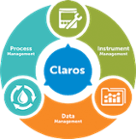
Claros Water Intelligence System
Skupine izdelkov Process Management
- Rešitve za:
- odstranjevanje BPK/KPK
- nitrifikacijo/denitrifikacijo
- odstranjevanje fosforja
- upravljanje obdelave blata
Data Management- Rešitve za:
- zbiranje podatkov
- vizualizacijo podatkov in analitiko
- poročanje
- točnost podatkov
Instrument Management- Rešitve za:
- vzdrževanje
- odpravljanje težav
- oddaljen dostop
- laboratorijske in procesne primerjave
-
Claros Water Intelligence System
- PANOGE
- Servis
- Novice & Dogodki
Slovenija
Izberite državo ali regijo:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
KARIERE 059 051 000
Fosfor
Kaj je fosfor?
Fosfor (F) je kemijski element z atomskim številom 15 in relativno atomsko maso 31. Ker je fosfor zelo reaktiven, v naravi ne obstaja kot prosti element. Fosfor se navadno pojavi v obliki fosfata v mineralih. Fosfat je navadno v zemeljski skorji s koncentracijo pribl. 1 g/kg.
Poznamo dve vrsti elementarnega fosforja – beli in rdeči fosfor. Kadar je beli fosfor izpostavljen kisiku, oddaja šibek sij, ki ga povzroča oksidacija (pojav je znan tudi kot kemiluminiscenca).
Fosfor spada v skupino elementov, ki se imenujejo pniktogeni, v katero spadajo dušik, fosfor, arzen, antimon, bizmut in moskovij (začasno ime: ununpentij). Ti elementi so združeni v skupino zaradi njihove podobne atomske zgradbe, ki jim omogoča, da tvorijo stabilne spojine zaradi njihove težnje po tvorbi dvojnih in trojnih kovalentnih vezi. Pniktogeni so na sobni temperaturi v obliki trdne snovi – razen dušika, ki ostaja plin.
Kompleksni organizmi, kot so rastline in živali, potrebujejo fosfor, ker so fosfati sestavni del DNK, RNK, ATP in fosfolipidov. Fosfor se uporablja pri izdelavi detergentov, pesticidov, živčnih strupov in predvsem gnojil.
Fosfati/ortofosfati
Pri ortofosfatu (enem od najpogostejših fosfatov) se en atom fosforja veže s štirimi atomi kisika. Ortofosfat včasih imenujemo tudi »reaktivni fosfor«, saj se zlahka veže z drugimi elementi brez elektrona, saj imajo trije "dodatni" elektroni v atomih kisika možno tendenco, da se vežejo s protoni.
Kondenzirani fosfati
Kondenzirane fosfate sestavlja več molekul ortofosfata, ki so "kondenzirane" skupaj in delijo kovalentno vez med pridruženimi atomi fosforja (P) in kisika (O). V to skupino spadajo metafosfat, pirofosfat in polifosfat, ti pa se pogosto uporabljajo za nadzor korozije v sistemih za distribucijo pitne vode.
Skupna količina fosforja/organskega fosforja
Skupna količina fosforja je vsota vsega prisotnega fosforja: ortofosfatov/fosfatov, kondenziranih fosfatov in organskega fosforja. Organski fosfor je navadno prisoten v obliki fosfatov, ki jih vsebuje organska spojina ali se nanjo veže.
Zakaj meriti fosfor?
Čeprav fosfati ne prispevajo k težavam z vonjem in okusom in zato morda niso ciljni v pitni vodi, lahko visoke ravni fosfatov v izlivu odpadne vode pomembno vplivajo na okoliški ekosistem. Visoke ravni fosfatov v vodnem viru lahko povzročijo razraščanje alg in pospešijo rast rastlin; to lahko povzroči evtrofikacijo in cvetenje alg. Ko se to zgodi, ribe in vodni živelj ostajajo brez kisika, kar privede do poginov velikih rib in uničenja habitatov. Merjenje fosfata v izlivu odpadne vode je kritično za ohranjanje zdravega sistema in zaščito prostoživečih živali. Na številnih področjih veljajo stroge omejitve glede izpustov fosfatov za zaščito ekosistema, v katero se izlivajo te vode. Ravni fosfatov niso pomembne le z vidika varovanja ekosistema, saj zaradi njihovega nespremljanja in nenadzorovanja lahko pride do kršitev in glob. Obrati za pripravo pitne vode, ki uporabljajo fosfate za nadzor korozije, morda morajo spremljati fosfate v obdelani vodi, sistemih za distribucijo pitne vode in pri drugih fazah procesa obdelave. Rešitve družbe Hach® so zasnovane tako, da je z njihovo uporabo zagotovljena skladnost s predpisi, poleg tega pa vašim upravljavcem zagotovijo znanje, ki ga potrebujejo za sprejemanje odločitev za obdelavo.
Pri družbi Hach so vam na voljo testna oprema, viri, usposabljanje in programska oprema, ki jih potrebujete za uspešno spremljanje in upravljanje ravni dušika v vaši procesni aplikaciji.
Priporočeni izdelki za merjenje fosforja
Analizatorji fosfatov Hach so zasnovani za trpežne terenske sisteme ter zagotavljajo lahek dostop do reagentov in obrabnih delov..
V trgovinoEZ Series Total Phosphorus Analyzers
Spletni analizatorji serije EZ ponujajo več možnosti za spremljanje skupnega fosforja v vodi.
V trgovinoSpletni analizatorji serije EZ ponujajo več možnosti za spremljanje fosfata v vodi.
V trgovinoZa delovanje analizatorja fosfatov 5500 sc do 90 dni sta potrebna le dva litra reagenta; to obdobje pa je dvakrat daljše kot pri njegovih predhodnikih, analizatorjih serije 5000.
V trgovinoDružba Hach je inovator na področju spektrofotometrije in na trgu analize vode ponuja številne vodilne spektrofotometrične instrumente.
V trgovinoZa vas imamo pravo rešitev, ne glede na to, ali iščete napravo za testiranje samo enega parametra, kot je DR300, ali bolj izpopolnjen instrument za brezskrbno delo, kot je DR900, ki lahko meri številne parametre z do 90 metodami.
V trgovinoInstrument LT200 je zasnovan tako, da prihrani čas in zagotavlja natančnost testiranja, pri katerem je potreben razklop vzorca.
V trgovino
Pri katerih procesih je potrebno spremljanje fosforja?
Pitna voda
Površinske vode lahko vsebujejo povišane koncentracije fosfatov zaradi odtoka pri kmetovanju, ki lahko povzroči evtrofikacijo površinskih voda z razraščanjem alg in sproščanjem cianotoksinov. Kondenzirani fosfati se pogosto uporabljajo za nadzor korozije v sistemih za distribucijo pitne vode, zato je pri postopkih čiščenja pitne vode morda treba spremljati fosfate v neobdelani in distribuirani obdelani vodi.

Obdelava odpadne vode
Fosfor je bistveno hranilo za rastline in zlasti za rast alg. Izliv fosforja skupaj z drugimi bistvenimi hranili v odpadni vodi spodbuja rast alg v tokovih, v katere se izlivajo odpadne vode. Alge povzročajo težavo z okusom in neprijetnim vonjem, so neprijetnega videza, zlasti pa ustvarijo ogromno potrebo po kisiku po končanem cvetenju alg. Izčrpavanje kisika, ki ga povzročijo umirajoči cvetovi alg, je strupeno za ribe, povzroča pa tudi znatne motnje v vodnem okolju. Zato regulativne agencije pogosto strogo regulirajo količino fosforja, ki je lahko prisotna v izlivih odpadne vode.
Za odstranjevanje fosforja iz odpadne vode se najpogosteje uporabljata metodi biološkega odstranjevanja in kemičnega obarjanja. Ti procesi se navadno imenujejo terciarna obdelava in zahtevajo spremljanje fosforja.

Kako poteka spremljanje fosforja?

Kolorimetrične metode (ortofosfat)
Ortofosfat (reaktivni fosfor) se združi z molibdatom v kislem mediju, da nastane modra ali rumena barva. Upoštevajte, da noben analitični preizkus ni popoln in da je nekatere kondenzirane fosfate mogoče izmeriti tudi s temi preizkusi. Zaradi kislih snovi je nekatere suspendirane ortofosfate mogoče zaznati, če vzorec ni bil najprej filtriran na velikost 0,45 mikrona. Za merjenje skupne količine fosforja, vključno s fosfati v delcih, je treba uporabiti preizkus skupne količine fosforja, ki vključuje strogo razklop vzorca, da se večina fosfata v delcih pretvori v raztopljeno obliko.
Namizni/prenosni:
LCK348, metoda Fosformolibden modra
LCS349, metoda Fosformolibden modra
Reactive Phosphorus LR Chemkey (PPA)
Reactive Phosphorus HR Chemkey (PPA)
Spletni:

Fosfat za kislinsko hidrolizo/kondenzirani fosfat
Če želimo izmeriti kondenzirane fosfate, jih moramo najprej pretvoriti v ortofosfat s pomočjo žveplove kisline in toplote, tako da se vzorec razkraja 30 minut pri temperaturi 150 °C. To se imenuje "fosfat za kislinsko hidrolizo", saj se kondenzirani fosfati hidrolizirajo v ortofosfat. Po razklopu se za merjenje ortofosfata uporabi metoda z askorbinsko kislino ali molibdovanadatom. Tudi nekateri organski fosfati se hidrolizirajo v ortofosfat, zato v rezultatu ni izražena količina "čistega" kondenziranega fosfata. Seveda vam bosta samo razklop vzorca in kolorimetrični test povedala koncentracijo tako izvornega ortofosfata kot kondenziranih fosfatov. Če pa želite podatek izključno za koncentracijo kondenziranega fosfata, preprosto izvedite ortofosfatni test na istem vzorcu brez razklopa in ta rezultat odštejte od prve vrednosti koncentracije.
Skupna količina fosforja/organskega fosforja
Organski fosfati so trmaste spojine, ki se nerade razgradijo. Za testiranje je najprej potreben razklop vzorca z žvepleno kislino in toploto, dodati pa je treba tudi močan oksidant, kot je kalijev persulfat, da se ortofosfati ločijo od organskih snovi. Po razklopu se lahko za merjenje koncentracije fosfata uporabi metoda z askorbinsko kislino ali z molibdovanadatom. Pri opisanem testu se bodo vse različne oblike fosfata pretvorile v ortofosfat, kar pomeni, da je pri rezultatih izražena skupna količina fosforja. Če želite poznati koncentracijo samo za organsko vezane fosfate, je treba opraviti test s kislinsko hidrolizo ter te rezultate odšteti od koncentracije skupne količine fosforja (koncentracije skupne količine fosforja bodo vedno večje od koncentracije ortofosfata).
Namizni:
Spletni:
Pogosto zastavljena vprašanja
Ali se analizator Phosphax sc lahko uporablja za morsko vodo?
Ne, analizator Phosphax sc se ne more uporabljati za morsko vodo, ker ta metoda deluje samo do koncentracije 1.000 mg/L klorida. Vsebnost klorida v morski vodi navadno presega 19.000 mg/L.
Kakšna rje razlika med modro in rumeno metodo za fosfate?
Reaktivni fosfor se lahko meri kolorimetrično z uporabo več različnih kemikalij. Najprej fosfor reagira z molibdatom v kisli raztopini in tvori kompleks fosfomolibdata. Za meritve v nizkem merilnem območju se kompleks fosfomolibdata reducira bodisi z aminokislino bodisi askorbinsko kislino, kar ustvari značilno modro barvo molibdena. Meritve v visokem območju se lahko opravijo z reakcijo kompleksa fosfomolibdata in vanadijevim reagentom, da nastane rumena obarvanost. Barvna intenzivnost tako pri modrih kot rumenih kompleksih je sorazmerna s koncentracijo fosforja v vzorcu.